2016年1月,美国妇产科医师学会(ACOG, American College of Obstetricians and Gynecologists)发布了子宫颈癌的筛查和预防实践指南(ACOG Practice Bulletin No. 157, ObstetGynecol. 2016;127:185-7.),以替代2012年11月发布的第131号实践指南。ACOG实践指南主要是对妇产科医疗实际工作各领域最新技术及临床治疗信息进行总结。这些实践指南及临床处理建议都是在大量证据基础上制定的。ACOG 是美国最主要的提供妇女健康保护和治疗的专业学会,有58,000名会员。ACOG的实践指南对美国妇产科医生及相关医生临床工作起最主要指导作用。得益于广泛宫颈癌筛查,美国近30年来宫颈癌发病率降低了50%以上:1975年发病率为每10万女性14.8例,2011年这一数字降低至了6.7;死亡率也从每10万女性5.55例同步降低至2.3例。2011年,美国癌症学会(ACS)、美国阴道镜和宫颈病理学会(ASCCP)及美国临床病理学会(ASCP)更新了宫颈癌筛查指南(Saslow D, et al. CA Cancer J Clin 2012;62:147–72),随后美国预防服务工作组(USPSTF)也发布了最新筛查指南(Moyer VA. Ann Intern Med 2012;156:880–91)。
2014年4月,美国食品和药品管理局(FDA)批准罗氏HPV检测可用于宫颈癌初筛;2015年2月ASCCP及妇科肿瘤学会(SGO)14位专家学者发布了一关于HPV检测在宫颈癌筛查中的临时建议指南(Huh WK et al. ObstetGynecol 2015;125:330–7)。美国临床医生和病人现存在着一个复杂或疑惑的问题,在新技术新方法层出不穷的今天,宫颈癌筛查该采取什么样的方案?HPV检测是否可以代替细胞学筛查?根据不同年龄制定筛查方案时,不同年龄女性的风险-获益比该如何平衡?ACOG157号实践指南非常全面的总结了美国妇女子宫颈癌筛查和预防的历史及现状,宫颈细胞学应用和发展,细胞学TBS报告的逐步修订,高危HPV检查及HPV基因分型在宫颈癌筛查中的应用,对细胞学和HPV检查有异常的妇女临床处置指南的修订等。我们将ACOG 157号实践指南全文翻译,由于章节篇幅所限,分为3部分连续发布,不足之处,敬请批评指正。有兴趣的朋友强烈建议大家阅读全文。
临床问题和建议
宫颈癌筛查应在21岁开始。不管女性第一次性生活发生在几岁或有其他行为相关的危险因素,小于21岁的女性不做筛查,除外HIV感染女性(表1)(6)。不考虑开始性生活时间,建议21岁开始筛查,因为这个年龄组的女性很少发生癌,并且缺乏此类筛查有效的资料(74,75)。仅有0.1%的宫颈癌病例发生在20岁之前(1),也就是说,15-19岁的女性中,每年每1,000,000人中有大约1-2例宫颈癌(1,76)。此外,美国和英国的研究表明年轻女性的筛查不能降低其宫颈癌的发生率(74,77)。
表1. 宫颈癌的筛查方法:美国癌症学会、美国阴道镜和宫颈病理学会、美国临床病理学会联合建议
人群 | 筛查方法的建议 | 说明 |
21岁以下女性 | 无需筛查 | |
21-29岁女性 | 每3年行细胞学检查 | |
30-65岁女性 | 每5年行细胞学检查和HPV联合检测(推荐) | 不推荐单独HPV检测 |
每3年一次细胞学检查(可选) | ||
65岁以上女性 | 既往多次筛查阴性,则无需筛查 | 既往有CIN2、CIN3或AIS,应继续常规的该年龄段的筛查,至少进行20年 |
全子宫切除术后女性 | 无需筛查 | 适用于没有宫颈,且过去20年未曾有CIN2,、CIN3、AIS和宫颈癌病史者 |
接受HPV疫苗的女性 | 依照各年龄段的建议(与未接种疫苗的女性相同) |
缩写:CIN,宫颈上皮内瘤变;HPV,人乳头瘤病毒;AIS:原位腺癌。
年轻女性通常在阴道性交后(30,31,33,34,77,78)和其他性行为(79)后不久获得HPV感染。而几乎所有人都可以在1-2年内依靠免疫系统清除病毒而不发生瘤变(23,32,33,35-38)。青少年患癌很罕见,但上皮内瘤变不罕见。对10,090例12-18岁女性进行巴士涂片检查,422例标本报告LSIL(5.7%),仅55例标本(0.7%)为HSIL(80)。
比指南建议的时间更早的进行筛查可能会增加患者的焦虑、患病率和花费,并导致过度随诊。要特别注意对青少年带上性传播疾病或潜在癌前病变的标签所导致的情绪反应,因为青少年期是高度重视自我形象和刚开始性活动的时期。有研究表明既往行宫颈病变切除的女性发生早产的几率明显升高(81)。但一项系统综述和荟萃分析显示,只有与既往宫颈细胞学结果正常和阴道镜检查阴性的人相比,接受宫颈病变切除的女性早产风险才会增加(82)。尽管对于LEEP治疗和早产的关系有争议,但对年轻女性避免不必要的宫颈切除和消融治疗是明智的(83)。
生育卫生保健开始不应基于宫颈癌筛查(84)。对于小于21岁女性宫颈癌的重要预防策略包括,HPV疫苗接种和关于安全性行为咨询以限制接触性传播感染。
筛查应做何种检查?
HPV检测较细胞学检查更敏感,但特异性较低(85)。在2011年ACS、ASCCP和ASCP联合指南和USPSTF指南中不建议对小于30岁女性进行联合筛查,因为这个年龄组性活跃的女性高危型HPV感染率高,但宫颈癌的发生率很低(6,86)。对小于30岁女性人群使用联合筛查将会发现大量一过性没有致癌性的HPV感染。对小于30岁人群,与单独进行细胞学筛查比较,进行联合筛查敏感性增加,特异性降低,将会导致更多的检查,但对降低癌症发生无益(87)。
30岁以上女性如果细胞学和高危HPV检测均为阴性,那么在后续4-6年中发展为CIN2或CIN 3的风险极低(88)。且风险远低于仅有细胞学阴性结果的女性(85)。在北加利福尼亚Kaiser Permanente的一项队列研究中,5年内 CIN 3 +风险:单独细胞学筛查阴性女性为0.26,联合筛查阴性的为0.08(89)。
有3项随机试验对30-65岁女性进行联合筛查和单独细胞学筛查进行了比较(90-92)。每一项试验的方案复杂,在评价HPV阳性患者的方法上也有差别。在每一项试验中,第一轮检测使用联合筛查组发现高级别病变的比例较高,而第二轮中后续单独应用细胞学检测发现患癌机率很低。第一项试验表明在第二轮筛查中CIN3和癌检出率明显降低,第2项试验表明第二轮筛查CIN3和癌的检出率显著下降,从0.03%至0%(90,91)。第三项研究未报道癌症检出比例的差异(92)。
单独细胞学检查对宫颈腺癌的检出情况不如宫颈鳞癌(93)。联合检测对于发现宫颈腺癌及其癌前病变要优于单独细胞学检查(94,95)。
告知患者宫颈癌筛查的特点、局限性、以及适当的延长筛查间隔,这些都是非常重要的。不管宫颈癌筛查的频率,都建议健康女性每年查体,即使不是每次就诊时都要行宫颈癌的筛查(96)。
对21-29岁女性宫颈细胞学筛查的最佳频率是多久?
几乎没有研究特别强调21-29岁女性的筛查间隔。一项模拟研究观察20岁女性筛查10年以上的结局,预测如果这些女性每3年而不是每年筛查一次,她们接受的阴道镜操作会减少一半(187/1000和403/1000),而终身的患癌风险仅有很小差异(0.69% vs 0.33%)(70)。这和一项研究中每隔1年、2年、3年筛查的结果是相似的(97)。与每3年筛查一次相比,每2年一次相关的癌症风险几乎没有差异(39例/每100,000例 Vs 37例/每100,000例),但后者进行更多阴道镜操作(134例/每100,000 Vs 176例/每100,000)。英国的一项研究显示,20-39岁女性在其末次阴性结果的检查后,间隔2年或3年筛查,其宫颈癌的发病风险没有差异(98)。每年筛查以投入巨大的花费进行检查操作和治疗,而仅使宫颈癌病例数得到微小提升,因此不应采用。2年和3年筛查间隔在降低宫颈癌风险方面相似,因此采用3年间隔方案需要的额外检查更少,因此对于21-29岁女性应每3年筛查一次。不必每年行宫颈癌的筛查。
对30-65岁女性宫颈细胞学筛查的最佳频率是多久?
对30-65岁女性,建议每5年进行一次联合筛查。如果单独细胞学筛查,传统或液基细胞学检查,每3年一次。不必每年筛查。
与单独细胞学筛查相比,联合筛查的敏感性更高,可以提高CIN3的检出率(6,88)。然而特异性降低则需要更多的随访检查。到目前为止,每3年一次细胞学筛查使得癌症的发生率降低,且已成为保健标准并被接受。以此为基准,每5年一次的联合筛查能轻微降低癌症发病率,而筛查次数更少,阴道镜检查的随诊更少。一项对7个欧洲研究的汇总分析报道,联合筛查结果阴性之后6年患CIN3或癌的风险为0.28%,而细胞学检查结果阴性3年后该风险为0.51%(88)。
一项北加利福尼亚Kaiser Permanente队列研究,单独细胞学检查结果为阴性的女性3年后患CIN 3 +风险为0.16,而联合筛查结果阴性的5年风险为0.08(89)。
美国卫生保健研究和治疗机构(Agency for healthcare Research and Quality)曾进行癌症、死亡和创伤的模型研究(经阴道镜评价)(97)。大范围假设中设立3种独立模型,每5年联合筛查与每3年细胞学筛查相比,癌症患者数、癌相关的死亡数、和阴道镜检查次数均相似,或更少(每1,000人终身癌症患者6.23-7.39 Vs 5.98-8.97;死亡数1.10-1.35 Vs 0.95-1.55;626-907 Vs 416-1,090)。
单独细胞学筛查可以作为联合筛查的替代方案,每3年一次持续到65岁。过去数十年的研究显示有组织的的宫颈癌筛查项目,每年一次细胞学检查并没有比间隔2年,或3年获得更多的益处(98-101)。在年轻女性中,模型研究显示1年和3年间隔的筛查均产生低的宫颈癌发生率(70,97)。每3年一次的筛查其患癌率稍高,但阴道镜操作的次数明显较少。决策分析表明每3年一次细胞学筛查和每5年一次联合筛查能在获益和筛查负担之间获得最佳平衡(97)。ACS、ASCCP和ASCP宫颈癌筛查指南共识会议发现,在任何一个年龄组,先前细胞学检查阴性的都没有高质量数据来建议改变筛查间隔(6)。一项配伍的病例对照研究计算不同筛查间隔患浸润性宫颈癌的风险,发现该风险不随既往异常细胞检查结果病史,或既往筛查正常结果的次数而改变(102)。
多大年龄应该停止筛查?
65岁及以上的女性也会罹患宫颈癌。这个年龄段的女性占美国女性人群的14.1%,但占新发宫颈癌病例的19.6%(1,103)。然而,与年轻女性一样,大多数宫颈癌发生于未曾接受筛查或筛查不充分的女性(104)。
因为宫颈癌发生在HPV感染后的中位时间15-25年,对这个年龄段的女性筛查仅能预防极少数宫颈癌病例。模型研究表明,每3年一次细胞学筛查直到65岁,以后每3年一次筛查直到90岁,每1,000位妇女中能预防约1.6例癌症和0.5例癌症死亡(97)。如此微小的收获需要相当的代价,包括增加了阴道镜操作。由于该年龄段妇女新感染病毒进而进展为癌的风险很小,即使有新的性伴侣,也没有必要进行筛查。
对于这个年龄组女性,绝经期后常见的上皮萎缩导致可能假阳性的细胞学筛查结果,因此需更复杂的筛选。一项研究指出,对于绝经后女性,异常宫颈细胞学结果的阳性预测价值非常低(105)。大多数阳性的巴士试验结果是假阳性,这很容易导致一些多余的操作检查、引起患者的焦虑和花费的增加。
对于全子宫切除术后的女性,何时应停止筛查?
原发的阴道癌是最罕见的妇科恶性肿瘤(2)。已切除子宫且没有CIN2及以上病变病史的患者发生阴道癌的风险很低。该组人群中,细胞学筛查发现异常的可能性很小,阳性预测值很低。来自19个研究的系统性回顾研究收集了子宫切除且宫颈没有CIN病变的6543名和子宫切除而宫颈有CIN3病变的5037名妇女(106)。发现那些没有感染CIN的子宫切除女性在随访中,仅1.8%有异常的阴道细胞学筛查结果,0.12%阴道活检有上皮内瘤变。没有发现癌患者。对于这类女性,继续行阴道细胞学检查没有意义,尤其是因为发展为阴道癌的风险极低,且其将会造成不便,焦虑和过度治疗。
子宫切除前有宫颈高级别上皮内瘤变患者,手术后其在阴道残端可发展成复发性上皮瘤变或癌(107,108)。一项系统性回顾针对既往CIN3的一组女性,14.1%病例中发现细胞学异常结果,但活检发现阴道上皮内瘤变却很少(1.7%),仅有一例癌被报道,在子宫切除术后3年诊断(106)。HPV检测在该人群中的意义尚不清楚。患者如已行全子宫切除,但既往20年内有CIN2或以上病变病史或曾患宫颈癌,则应继续筛查。对仍保留宫颈和既往有CIN2及以上病变病史女性,建议其继续筛查20年(40)。因此,在最初的治疗结束后20年每3年一次单独细胞学筛查,对子宫切除的患者是合理的。
单独HPV检测能否用作宫颈癌筛查?
基于HPV检测的等价性,并且在ATHENA试验中优于单独单独细胞学筛查,FDA修正了HPV检测标签,包括女性在25岁时行宫颈癌的初始筛查。在目前主要的临床指南中仍然推荐单独细胞学检查和联合筛查。2015年,ASCCP和SGO发布临时指南使用FDA批准的HPV检测对宫颈癌的初始筛查(8),临时指南委员会得出结论,因为它的等价或优越的有效性,FDA批准对于25岁以上女性宫颈癌筛查,HPV初始筛查可以替代当前细胞学检查(8)。
如果使用初始HPV检测,应按ASCCP和SGO的临时指南执行(8),因为许多重要的问题在其中没有阐述。25岁之前的女性不用行HPV检测;可行单独的细胞学检查。初始HPV筛查结果为阴性应不短于每3年进行重新筛查。阳性结果应进行HPV-16和HPV-18的基因分型,如果基因分型检测结果是阴性,行细胞学检查。如果基因分型和细胞学检查结果阴性,患者应在1年内进行随访检测。
虽然在临时指南中没有明确提出,但有很重要的几点。对于既往筛查结果阴性的女性在65岁时可以停止筛查。对于没有宫颈的女性不用行初始的HPV检测。对于HPV初筛阳性女性1年随访期间基因分型阴性而细胞学检查未说明,行联合筛查是合理的。对HIV阳性或免疫功能低下女性没有指导检测方法的使用。只有一项由FDA批准的特定的HPV检测作为初始筛查(109)。没有其他检测得到批准。如果进行初始筛查,它应该通过了批准测试。
联合检查中细胞学ASCUS和HPV阴性女性,如何处理?
ASCUS的处理一直都存在诸多疑问。常常一旦诊断即被处理,但事实上该结果代表诊断的不确定性,包括了有鳞状上皮内瘤变患者及没有鳞状上皮内病变的患者。HPV检测是分流细胞学ASCUS的有效方法。HPV阴性人群,癌前病变的风险非常低。在北加利福尼亚Kaiser Permanente队列研究中,对于ASCUS和HPV阴性者,30-64岁发展成CIN3+和癌的5年风险分别为0.43和0.05,但是显著高于联合筛查均为阴性女性的5年风险(分别为0.08和0.011)(112)。患CIN 3+风险实际上是单独细胞学阴性结果的女性的风险;因此采用同样的筛查结果的处理原则,2012年ASCCP共识指南对异常宫颈癌筛查和癌前病变的管理(40)建议30–65岁女性应该在3年内有后续联合筛查而不是5年,正如2011年筛查指南所推荐的一样(6)。如果3年的联合筛查结果是阴性的,可以返回到适合年龄的常规筛查(40,111)。
表2. 宫颈癌筛查结果处理
筛查方法 | 结果 | 处理 |
细胞学筛查 | 细胞学阴性 ASCUS和HPV阴性 | 3年内重复筛查 3年内联合筛查 |
其他情况 | 参照ASCCP指南 | |
联合筛查 | 细胞学阴性、HPV阴性 ASCUS、HPV阴性 | 5年重复筛查 3年重复筛查 |
细胞学阴性、HPV阳性 | 选项1:随访12个月联合筛查 选项2:HPV-16或HPV-18分型检测 l 如HPV-16或HPV-18阳性,建议阴道镜; l 如HPV16或HPV16/18阴性,随访12个月联合筛查 | |
其他情况 | 参照ASCCP指南 |
联合筛查中细胞学检查阴性HPV阳性女性,如何处理?
30岁及以上女性,联合筛查结果如细胞学阴性HPV阳性,应依照下列两种途径之一进行处理(Fig1):
1. 12个月内重复联合筛查。如果重复的细胞学检查为ASCUS或更高级别病变,或HPV仍为阳性,应建议患者行阴道镜。否则,患者应3年内行联合筛查。细胞学水平的诊断评估应该执行之前推荐的2012 ASCCP修正的异常宫颈癌筛查结果的管理指南对LSIL及任何异常病变(ASC-US或更高)的处理(40)。
2. 立即行HPV-16和HPV-18的HPV分型检测。如果HPV-16和(或)HPV-18阳性,应直接行阴道镜检查。如果两种HPV亚型检测系阴性,应在12个月内重复联合筛查,对其结果的处理参照2012ASCCP修正的异常宫颈癌筛查结果的管理指南(40,111)。
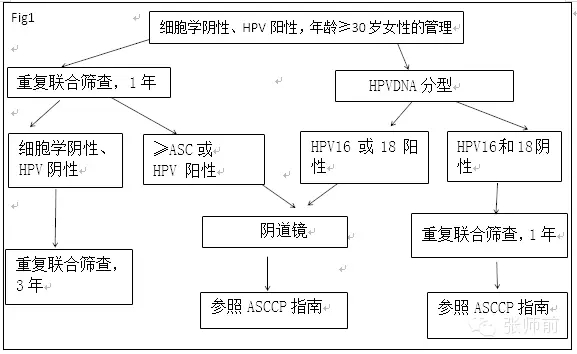
没有研究直接对比HPV阳性和细胞学阴性患者的不同处理方法。队列研究结果为重复联合试验提供了合理性,其结果表明大多数一过性感染将在12个月内被清除。一项队列研究报道,60%的HPV阳性、液基细胞学阴性的女性,会在6个月内清除感染(25)。一项独立的队列研究报道67%患者在1年内清除HPV感染(29)。感染持续1年的将有21%在30个月内发展为CIN2或更高级别的病变。在北加利福尼亚Kaiser Permanente的队列研究中,有47%女性1年内持续HPV阳性。重复检测时,任何异常的联合筛查结果相较基线上同样异常病变的风险要高(112)。
1年内重复联合检查,则大多数一过性感染HPV并没有致癌高危因素的患者能有足够的时间清除HPV感染,并确定一小部分人为癌前病变高危患者,需行阴道镜检查。在Kaiser 队列研究中也提到了阴道镜对高危异常病变的处理和3年随访联合筛查结果恢复正常。
FDA批准的HPV检测能被用来明确联合筛查阳性患者的HPV是否有16 或18亚型。如果检测到HPV-16或HPV-18,几年内患CIN3的风险接近10%,如此风险足以需要进行阴道镜评价(18,113,114)。这些检查对HPV阳性、细胞学阴性的患者可以作为处理的一种选择,如果阳性,建议患者立即行阴道镜。如果结果阴性,1年后重复联合筛查,因为其他亚型病毒所致的风险仍然存在,其结果的处理见Fig 1(40)。(未完待续)





 2020
2020